Come si arriva a creare un vaccino? Quanto tempo serve?
17/12/2020
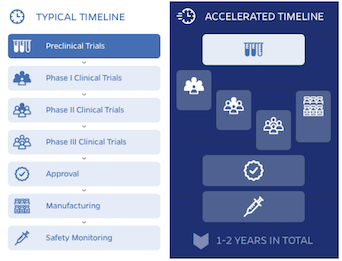
A questa e ad altre domande risponde la Johns Hopkins University che, con l'ausilio di una efficace infografica, mostra le due strade che portano a realizzare un vaccino. Il tema è di attualità; da pochi giorni il primo vaccino ha iniziato ad essere somministrato in UK e sta per esserlo in USA.
Lo sviluppo di un nuovo vaccino richiede mediamente dai 5 ai 10 anni, talvolta di più per verificarne sicurezza ed efficacia mediante trial clinici, completare il processo di approvazione da parte delle autorità regolatorie, produrne una quantità sufficiente e distribuirlo su larga scala. Un tipico esempio è rappresentato dal vaccino contro l'influenza stagionale.
Ma dall'inizio della pandemia sono passati meno di 12 mesi e già abbiamo il primo vaccino in uso e diversi altri che stanno per entrare sul mercato. Come è possibile accelerare in questo modo la ricerca, lo sviluppo e i trial per verificarne sicurezza ed efficacia?
Esistono diversi metodi per farlo, senza compromettere la sicurezza del vaccino e mantenendo elevati standard scientifici ed etici. Ce lo spiega con chiarezza l'infografica della JHU.
- Le fasi dei trial clinici possono essere combinate. Nel caso del vaccino contro il SARS-CoV-2, in alcuni casi sono stati combinati i trial di fase 1 e 2 (sicurezza, dosaggio e risposta immune), in altri sono stati combinati i trial di fase 2 e 3 (sicurezza ed efficacia in popolazioni ad alta incidenza della malattia).
- A causa dell'alto numero di casi in determinate aree, la probabilità di sviluppare la malattia nei due gruppi di soggetti vaccinati e vaccinati con placebo può essere misurata più velocemente.
- Un produttore deve inoltrare la richiesta di iniziare un trial clinico per ogni nuovo farmaco e l'autorità regolatoria può richiedere documentazione supplementare o fermare la procedura se solleva problemi di sicurezza.
- I governi hanno verificato le capacità produttive su larga scala delle aziende prima dell'inizio dei trial di fase 3, anziché dopo, come avviene nella procedura standard.
- Dopo aver completato con successo i trial di fase 3, il produttore del vaccino deve presentarne i dati di sicurezza, risposta immune ed efficacia per avere il via libera all'utilizzo nella popolazione generale.
Per saperne di più vai alla pagina della Johns Hopkins University.